Quali istruzioni per un conference abstract
Con le limitazioni sul numero di parole permesse negli abstract sempre più restrittive (dalle 250 nel abstract di manoscritti, alle 350-450 per il conference abstract), trovare spazio per fornire almeno le informazioni essenziali del nostro studio sembra davvero impossibile. Ma qual è il criterio per scegliere le informazioni "essenziali" da presentare?
In generale, ogni conferenza (con il proprio call for abstracts) ha le proprie istruzioni per gli autori a cui fare riferimento; tuttavia, a voler essere pignoli e precisi nel research reporting, le linee guida di riferimento "più autentiche" per la compilazione degli abstract (così come degli articoli scientifici) sono quelle sviluppate dall'ICMJE (International Committee of Medical Journal Editors) ed implementate da anni da numerosi da enti come l'Equator Network (Enhancing the QUAlity and Transparency Of health Research Network), la Cochrane Collaboration, COPE (Committee on Publications Ethics), ect.
Le linee guida (LG) sono specifiche in base al tipo di studio, dallo studio controllato randomizzato (CONSORT for abstracts), allo studio di accuratezza diagnostica (STARD), a quello di quality improvement (SQUIRE), ai protocolli (SPIRIT), con molte delle LG presentate sia in forma estesa che di checklist di facile consultazione. Sul sito si trovano anche utili riferimenti, definizioni e diagrammi decisionali (flowcharts) per capire quale LG è la più adatta al vostro caso.
In linea generale, la raccomandazione è quella di fornire le informazioni minime che permettano a colleghi di fare una prima valutazione critica del lavoro, e di prestare attenzione a non creare "misleading statements" che potrebbero influenzare la pratica clinica (magari di qualche collega che dall'altra parte del globo potrebbe avere accesso solo all'abstract piuttosto che al full paper o alla presentazione integrale dei dato al convegno).
Detto questo, le lacune degli abstract più frequentemente segnalate in letteratura sono:
- l'incompleta definizione del tipo di studio clinico eseguito e informazioni sul patient allocation, blinding, codice di registrazione dello studio
- la mancanza di "dettagli" numerici relativi ai principali outcome, come ad esempio i valori di significatività statistica, intervalli di confidenza, deviazione standard ed errore standard, dei valori assoluti per risk changes o effect size; e nel caso di studi di screening diagnostici, la mancanza di dati per sensitività, specificità e likelihood ratio.
In previsione del prossimo congresso, e della ormai prossima pausa estiva, consigliamo quindi una interessante visita al sito dell'Equator Network e alla pagina dei Toolkits con utili consigli per gli autori volenterosi di migliorare nel research reporting.
La Redazione
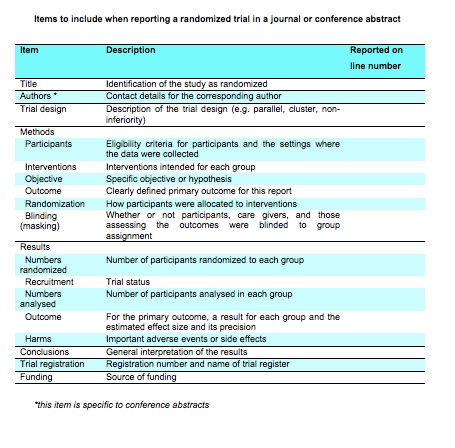
Checklist "CONSORT for Conference Abstracts". Immagine tratta dal sito CONSORT.ORG
Referenze
EQUATOR NETWORK. http://www.equator-network.org.Last accessed 20 july 2017.
IJMJE. Recommendations for the Conduct, Reporting, Editing, and Publication of Scholarly Work in Medical Journals. http://www.icmje.org/icmje-recommendations.pdf. Last accessed 20 july 2017.
CONSORT. http://www.consort-statement.org. Last accessed 20 july 2017.
